Die Inzidenz von Typ-1-Diabetes bei Kindern und Jugendlichen steigt kontinuierlich an. Pädiaterinnen und Pädiater haben daher im Alltag immer häufiger die typischen Symptome rechtzeitig zu deuten und diagnostisch sicher einzuordnen. Wie sieht die Standardtherapie heute aus? Und welche Vorteile bieten die seit Herbst 2021 zugelassenen AID-Systeme?
Der Diabetes mellitus Typ 1 ist in der Kinder- und Jugendmedizin mittlerweile die vorherrschende Stoffwechsel- und Autoimmunerkrankung. Niedergelassene Kinderärztinnen und Kinderärzte haben dadurch im Praxisalltag immer häufiger die typischen Symptome rechtzeitig zu deuten und diagnostisch möglichst sicher einzuordnen. Zudem sind sie mit der Komplexität moderner Behandlungsmethoden und diese Kinder betreffenden Inklusionsfragen konfrontiert. In dieser Situation kann eine Orientierungshilfe angebracht und nützlich sein.
Nachfolgend werden daher zunächst die derzeit gültigen epidemiologischen und immunologischen Erkenntnisgrundlagen vorgestellt, bevor der zweite Teil über die aktuellen Behandlungsstandards für diese chronische Erkrankung informiert.
Epidemiologie
Es ist allgemein bekannt: Die weltweite Inzidenz des Diabetes mellitus Typ 1 bei Kindern und Jugendlichen steigt kontinuierlich an [1]. In Deutschland erkrankten 15 % mehr Kinder und Jugendliche als gemäß der Trendanalyse 2011 – 2019 zu erwarten gewesen wären (24,4 vs. 21,2/100.000). Noch gravierender stieg die Anzahl der Neuerkrankungen bei Klein- und Vorschulkindern [2].
Die Inzidenz für Diabetes mellitus Typ 2 war bei Kindern und Jugendlichen bis 2016 auf einem stabilen, niedrigen Niveau [3]. Es bleibt abzuwarten, inwieweit sich diese Situation – bedingt durch die Tendenz zu Übergewicht und Adipositas vieler junger Menschen während der Pandemie – verändern wird [4].
Immunologie
In einer aufsehenerregenden Studie des Centers for Disease Control and Prevention in den USA wurde der Zusammenhang von COVID-Infektionen mit der Genese eines Diabetes mellitus untersucht. Die Autoren fanden bei Kindern und Jugendlichen ein signifikant erhöhtes Risiko, 30 Tage nach einer COVID-Infektion an Diabetes mellitus Typ 1 und Typ 2 zu erkranken [5].
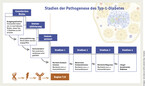
Es ist eine viel diskutierte, aber bislang nicht in Studien verlässlich bestätigte Beobachtung, dass Virusinfektionen bei der Manifestation von Autoimmunerkrankungen eine Rolle spielen. Solche pathophysiologischen Zusammenhänge werden – auch bedingt durch das Interesse an diesem Inzidenzanstieg – intensiv beforscht. Abbildung 1 gibt die 4 Stadien der Pathogenese des Diabestes mellitus Typ 1 wieder [6].
Eine genetische Prädisposition zeigt sich in der familiären Prävalenz. Bis zu 10 % der Kinder und Jugendlichen mit Typ-1-Diabetes haben Verwandte 1. Grades mit dieser Autoimmunerkrankung [7]. Den Progress der Autoimmunität bis zur manifesten Erkrankung mit autoimmuner Zerstörung der Insulin-produzierenden β-Zellen im Pankreas versucht man seit mehr als 30 Jahren besser zu verstehen. Hierzu existieren einige internationale Interventionsstudien in Phase II und III mit Beteiligung deutscher Kliniken für Kinder- und Jugendmedizin, die beispielsweise den Einfluss monoklonaler Antikörper bei Diabetes-Manifestation auf die Dauer der Remission untersuchen [8, 9]. Neben den bekannten Eigenschaften wie HLA-DR3-DQ2/-DR4-DQ8 und den Inselzell-Antikörpern (ICA, GAD-65, IA-2, IAA, ZnT-8) sollen weitere Biomarker dazu beitragen, Ansätze zur Immunmodulation in der Vorphase der Erkrankung zu individualisieren [8].
Bis valide Ergebnisse dieser Studien differenzierte Behandlungsoptionen ergeben können, erscheint es hilfreich, die etablierte Therapie der exogenen Insulingabe weiter zu optimieren.
Diabetes-Manifestation
Im Kontrast dazu sieht die Standardsituation eher wie folgt aus:
Die Diagnose Diabetes mellitus Typ 1 ist für die Familie des betroffenen Kindes meist überraschend und oft auch schockierend. Die typischen Symptome bei Diabetes-Manifestation wie- Polydipsie,
- Polyurie,
- verminderte kognitive Konzentrationsfähigkeit,
- körperliche Schwäche und Gewichtsabnahme
werden häufig erst spät wahrgenommen oder missinterpretiert. So wird etwa eine sekundäre nächtliche Harninkontinenz eher mit emotionalem Stress als mit dem Auftreten eines Diabetes mellitus verbunden. Kinderärztlicher Rat wird häufig erst gesucht, wenn die kleine Patientin bzw. der kleine Patient bereits seit Tagen über Bauchschmerzen klagt und erbricht. Dabei wäre die diabetische Ketoazidose (DKA) bei Manifestation vielfach vermeidbar, wenn über die charakteristischen Symptome umfassend aufgeklärt würde. Hierzu kann die DKA-Präventionskampagne der Arbeitsgemeinschaft Pädiatrische Diabetologie (AGPD)einen grundlegenden Beitrag leisten (Abb. 2) – allerdings nur, wenn möglichst viele kinder- und hausärztlich tätige Kolleginnen und Kollegen diese gut verständliche Aufklärung verbreiten würden. Hierzu bieten sich die Vorsorge-Untersuchungen wie die U6 und U7a an [10].
Bei stationärer Aufnahme haben ca. 30 % der Kinder und Jugendlichen eine DKA [11]. Dieser Anteil hat in Deutschland nach dem 1. Lockdown während der SARS-CoV-2-Pandemie sogar noch zugenommen [12].
Ein deutlich erhöhtes Risiko für Komplikationen wie diabetisches Koma, Elektrolyt-Entgleisungen und sekundäres Hirnödem besteht besonders bei Kindern mit einer schweren DKA (pH < 7,1). Neben der Gefahr akuter Komplikationen kann ihre Teilremissionsphase verkürzt sein [13]. Bereits nach einmaliger DKA sind diese Kinder von einer gestörten zerebralen Entwicklung mit niedrigerer Intelligenz bedroht [14].
Weiteres Vorgehen bei dem in der Kasuistik vorgestellten Jungen
Bei dem Patienten in der skizzierten Kasuistik wurde die Diabetesdiagnose anhand der Kriterien Gelegenheits-Glukose > 200 mg/dl und HbA1c > 6,5 % gestellt. Nach dem Blutzucker-Tagesprofil wurde unverzüglich die Behandlung mit Insulin s. c. notwendig. Der Nachweis von diabetesspezifischen Antikörpern (IA-2, GAD-65, ZnT-8) bestätigte wie bei seiner Zwillingsschwester die Verdachtsdiagnose: Diabetes mellitus Typ 1. Er befindet sich im Stadium 2 der Diabeteserkrankung (Abb. 1).
Obwohl wir 2021 im Klinikum Worms 2 Zwillingspaare mit jeweils gleichzeitiger Diabetes-Manifestation behandelten, findet sich in der Literatur keine Häufung der Diabeteserkrankung bei zweieiigen Zwillingen.
100 Jahre Insulin
Als geschichtlicher Ausgangspunkt für die aktuellen Therapiestandards können die Forschungen des Chirurgen Frederick Banting und des Physiologen und Biochemikers Charles Best gelten: Sie behandelten im Januar 1922 erstmals einen jugendlichen Diabetiker subkutan mit Insulin, nachdem sie zuvor Insulin aus der Bauchspeicheldrüse von Hunden isoliert hatten. Nachdem in den folgenden Jahrzehnten die Insulinqualität kontinuierlich verbessert wurde, arbeitet man heute an der Entwicklung "intelligenter" Insuline: Diese steuern ihre Insulinabgabe blutzuckerabhängig aus einem Depot an der Injektionsstelle.
ICT und Insulinpumpentherapie
Behandelte man zum Ende des 20. Jahrhunderts die Kinder mit wenigen aber regelhaft erfolgenden Injektionen und festen Mahlzeiten, repräsentieren mittlerweile eine intensivierte, konventionelle Insulintherapie (ICT) und Insulinpumpentherapie die bestmöglichen Behandlungsmethoden mit individuell angepassten Insulindosen und variablen Mahlzeiten.
In Deutschland werden in der Behandlung bei Kindern und Jugendlichen überwiegend Analoginsuline eingesetzt (Tab. 1). Bei der ICT ist ein langwirksames Analoginsulin (Insulin Glargin, Insulin Detemir, Insulin Degludec) die Basis und ein kurzwirksames Analoginsulin (Insulin Lispro, Insulin Aspart, Insulin Glulisin) wird als Bolus vor der Mahlzeit und zur Korrektur subkutan injiziert.
In der Insulinpumpe wird für die Basalrate, den Mahlzeit- und den Korrektur-Bolus ein kurzwirksames Insulin, meist ein Kurzzeit-Analoginsulin (s. o.), verwendet. Humaninsuline (Normal- und NPH-Insulin) werden in der Therapie bei Kindern und Jugendlichen nur noch selten eingesetzt.
Um einen individuellen Insulinbedarf zu ermitteln, nimmt man den Tagesbedarf des Patienten während der Insulingabe mittels Perfusor (0,05 – 0,1 E/kg/h) in den ersten Tagen nach der Manifestation unter Berücksichtigung des höheren Insulinbedarfs während der DKA. Der Tagesbedarf liegt dann bei 0,5 – 1 E Insulin/kg/Tag, aufgeteilt in 1/3 Basal- und 2/3 Bolus-Insulin. Der zirkadiane Basal-Insulinbedarf ist altersentsprechend unterschiedlich [16].
Kontinuierliches Glukose-Monitoring (CGM)
Ein kontinuierliches Glukose-Monitoring (CGM) sorgt in der Regel für eine erheblich erleichterte und zuverlässigere Behandlung "im Zielbereich" (Time in Range – TiR-Glukose: 70 – 180 mg/dl):- Das "Real time"(rt)-CGM misst mehrmals stündlich die interstitielle Glukosekonzentration mittels eines Sensors,
- ein Transmitter sendet den Wert an einen Monitor, ein Smartphone oder die sensorintegrierte Insulinpumpe und informiert digital in Echtzeit (rt) den Patienten und seine "Follower":
- Eltern, Betreuerinnen und Betreuer sowie Lehrerinnen und Lehrer, also alle Personen, die auf die Therapie Einfluss nehmen, müssen geschult sein, um eine sichere Handhabung zu gewährleisten (z. B. SPECTRUM-Schulungsprogramm, 2017).
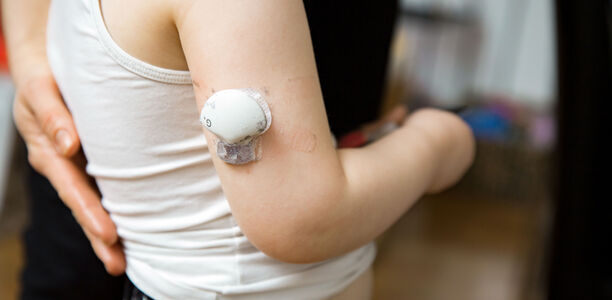
- Der Glukosesensor wird am Oberarm, Gesäß oder Bauch s. c. angebracht.
- Zunehmend werden werkskalibrierte Glukosesensoren eingesetzt, die keine Blutzuckermessung zur Kalibrierung benötigen.
- Das weit verbreitete intermittent scanning glucose monitoring (isc-CGM) mit Free Style Libre 2 wurde vom rt-CGM (Dexcom G6, FreeStyle libre 3, Guardian link 3 und 4) abgelöst, die die Patientin bzw. den Patienten warnen, wenn der Gewebezucker außerhalb des gewählten Bereiches liegt oder diesen in Kürze verlassen wird.
- Die Trendpfeile informieren die Patientin bzw. den Patienten zusätzlich über ihre/seine Glukosefluktuation und helfen bei der Tagesplanung.
Die Tragedauer der Sensoren beträgt je nach Modell 1 – 2 Wochen. Der vergleichsweise selten notwendige Wechsel kann für Patientinnen und Patienten, die zu Hautirritationen neigen, problematisch sein. Man kann zwischen einer irritativen Kontaktdermatitis durch Okklusion, Schwitzen, Pflasterentfernung und einer selteneren allergischen Kontaktdermatitis durch Sensibilisierung gegen Pflastermaterialien unterscheiden. Erweist sich beim irritativen Kontaktekzem die Hautpflege zumeist als ausreichend, sollte ein allergisches Kontaktekzem gemeinsam mit dem Diabetes-team versorgt werden.
Seit dem Beschluss des Gemeinsamen Bundesausschusses (G-BA) 2016 kann ein rt-CGM bei Patientinnen und Patienten eingesetzt werden, die ihre individuellen Therapieziele mit der Blutglukose-Selbstmessung nicht erreichen. Individuelle Therapieziele werden mit der Patientin bzw. dem Patienten und der Familie definiert und müssen häufig den Kostenträgern bei der Verordnung eines rt-CGM für Kinder und Jugendliche mit Typ-1-Diabetes zugänglich gemacht werden. Dabei kann ein rt-CGM verordnet werden:- zur Senkung der Hypoglykämierate (Häufigkeit, Dauer, Tiefe)
- bei rezidivierenden nächtlichen Hypoglykämien
- bei fehlender Hypoglykämie-Wahrnehmung
- bei stattgehabten schweren Hypoglykämien
- zur Verbesserung der Stoffwechseleinstellung ohne gleichzeitige Zunahme von Hypoglykämien
- zur Reduktion ausgeprägter Glukosevariabilität
(siehe auch Praxisempfehlungen der DDG, Version 2021).
Wenn das HbA1c-Therapieziel nach Ausschöpfen anderer stoffwechseloptimierender Maßnahmen und Schulungen nicht erreicht wird, kann ein rt-CGM die The-rapie verbessern. Bei Patientinnen und Patienten mit HbA1c-Werten über 8 % zeigen Studien eine signifikante Verbesserung des Langzeitwertes gegenüber einer Kontrollgruppe, die den Blutglukosewert blutig misst ohne Zunahme von Hypoglykämien [17].
Der Sensorglukosewert wird bei Einsatz mit einer sensorintegrierten Insulinpumpe automatisch übertragen. Über eine "Follower"-App sind die Glukosewerte zusätzlich via Internetverbindung zu verfolgen.
Seit mehr als 2 Jahren werden in Deutschland sensorintegrierte Insulinpumpen eingesetzt, bei denen die Insulinabgabe für den basalen Insulinbedarf und die Korrektur durch einen Algorithmus überwiegend automatisch gesteuert wird. Sie kommen damit dem Prinzip einer künstlichen Bauchspeicheldrüse, dem sogenannten "Closed Loop" sehr nah. Dass die Insulinpumpentherapie besonders bei den Klein- und Vorschulkindern durch die feine Insulindosierung die Therapie der Wahl ist, liegt auf der Hand und sollte auch leicht nachvollziehbar gegenüber den Kostenträgern zu begründen sein.
AID-Systeme
Mit den seit Herbst 2021 in Deutschland zugelassenen AID-(automatische Insulindosierung)-Systemen erreichen auch Schulkinder und Jugendliche, die bislang fern ihrer individuellen Therapieziele waren, eine überwiegend normnahe glykämische Stoffwechsellage, wenn sie bestimmte Regeln beachten. Diese Systeme vermögen neben Hypoglykämien auch Hyperglykämien auszugleichen und dadurch die Glukosevariabilität zu reduzieren.
Wenn auf AID umgestellt oder initial mit AID behandelt werden soll, bedarf dies einer guten Vorbereitung und Schulung der Patientin/des Patienten und der Familie. Es erweist sich nicht selten als eine zu überwindende Hemmung, dem technischen Gerät umfassend zu vertrauen. Aus der technischen Perspektive wird der Algorithmus durch häufiges Eingreifen weniger zuverlässig. Jedes System hat individuelle Faktoren, die bei der Planung bestimmt und programmiert werden müssen (Tab. 2). Das Kohlenhydrat-Insulin-Verhältnis (gKH/E), das für den Mahlzeitenbolus bestimmt ist, muss bei allen Fabrikaten abgestimmt sein.
Seit Herbst 2021 arbeitet die Klinik für Kinder- und Jugendmedizin in Worms mit vier AID-Systemen, ausgerichtet nach ihrer altersgemäßen Zulassung (Tab. 2).
Produktspezifische Schulungsinhalte bei AID
Bei der individuellen Schulung werden die systemspezifischen Einflussmöglichkeiten beispielsweise bei hormonellen Veränderungen (prämenstruell, Wachstumsphasen) und bei akuten Krankheiten vermittelt: Dafür hat Cam APS FX die "Boost"-Funktion und die Patientinnen/Patienten können im Bedarfsfall manuell korrigieren. Bei der Minimed 780G schärft die Reduktion der Zeit des aktiven Insulins die Autokorrektur und die Patientinnen/Patienten können nach Aufforderung manuell korrigieren. Bei t:slim X2 control-IQ können individuell programmierte Basalraten und Korrekturfaktoren für einen höheren Insulinbedarf eingesetzt und manuell korrigiert werden.
Alle Insulinpumpen mit AID funktionieren bei einer Störung des Advanced-Hybrid-Closed-Loop mit der programmierten Pumpeneinstellung (Basalrate). Dies ist dann der Fall, wenn CGM-Daten nicht per bluetooth gesendet werden. Für die MiniMed-Geräte ist ein Sicherheitsbereich definiert: Sobald dieser erreicht wird, schalten sie in den manuellen Modus um. Bei der MiniMed 670G wird diese Schwelle relativ leicht überschritten, z. B. bei Hyperglykämie 1 Stunde > 300 mg/dl oder wenn nicht rechtzeitig kalibriert wurde.
Es gelingt nahezu allen AID-Nutzerinnen und -Nutzern länger als in ihrer vorhergehenden Behandlung im Zielbereich (70 – 180 mg/dl) zu sein. Durch die geringere Glukosevariabilität sinkt in der Regel der individuelle Insulinbedarf. Erfahrungsgemäß kommt es durch die AID-Systeme nicht zu befürchteten Insulinüberdosierungen, wenn die jeweiligen Zulassungskriterien beachtet werden. Die automatische Insulinabgabe funktioniert besonders gut während des Schlafs. Sie gibt den Familien Lebensqualität zurück, die sie durch die Störung ihres Nachtschlafs, in denen sie den Blutzucker ihres Kindes häufig korrigieren mussten, mitunter gravierend eingebüßt hatten.
Für Klein- und Vorschulkinder mit Diabetes mellitus Typ 1 sind bislang drei der o. g. AID-Systeme nicht zugelassen und die Kosten für Cam APS FX werden von den gesetzlichen Krankenkassen noch nicht übernommen. Für diese Kinder ist nur eine sensorunterstützte Insulinpumpe mit Insulinunterbrechung bei (drohender) Hypoglykämie zugelassen (MiniMed 640G) [22].
Der Mahlzeiten-Bolus wurde bislang bei der ICT und der Insulinpumpentherapie mit dem KE-Faktor berechnet. Der KE-Faktor ist die Menge an Insulin, die der Patient benötigt, um 1 KE (10 g Kohlenhydrate) aus dem Blut aufzunehmen. Alle modernen Insulinpumpen arbeiten mit einem Bolus-Rechner, der mit dem Kohlenhydrat-Insulin-Verhältnis (gKH/E) zu jeder Mahlzeit programmiert wurde. Das gKH/E zeigt an, wie viele g Kohlenhydrate mit 1 E Insulin aus dem Blut aufgenommen werden können. Wenn man am KE-Faktor festhält, dividiert man 10 g Kohlenhydrate durch den KE-Faktor, erhält so das gKH/E und kann auf die Verwendung der Umrechnungstabellen verzichten.
Am Beispiel eines klinikinternen Therapieplans sind beide Maßeinheiten über diesen Rechenschritt angegeben (Abb. 3). In den Diabetesschulungen wird die jetzt allgemeingültige Maßeinheit (gKH/E) den KE-Faktor zumindest in der Kinder- und Jugendmedizin ablösen, da weit mehr als die Hälfte der Patienten mit einer Insulinpumpentherapie behandelt wird.
Ernährungsempfehlungen
Die Ernährungsempfehlungen für Kinder und Jugendliche mit Diabetes mellitus Typ 1 entsprechen weitgehend den allgemeinen Empfehlungen für gesundes, abwechslungsreiches Essen:- Die einzelnen Mahlzeiten sollten nicht zu groß sein und der Kohlenhydratanteil von 100 g nicht überschritten werden.
- Pausen von mehreren Stunden zwischen den Mahlzeiten sind günstig.
- Für die Verbesserung der Behandlung lohnt es, das gKH/E gut zu definieren, den Kohlenhydratanteil der Mahlzeit genau zu berechnen und vor dem Essen das kurzwirksame Analog-Insulin zu spritzen.
- Ein Spritz-Ess-Abstand von 10 – 15 Minuten gilt als physiologisch empfehlenswert. Davon kann man abweichen, wenn ein Kind extrem langsam isst, oder der Fett-Eiweiß-Anteil der Mahlzeit überwiegt (z. B. Lasagne, Lachs-Pfannkuchen).
- Sollte der Mahlzeiten-Bolus präprandial vergessen werden, so ist 1 Stunde postprandial nur noch die Hälfte zu spritzen da das AID-System den Blutzuckeranstieg bereits korrigiert.
- Der Dual-/verzögerte Mahlzeiten-Bolus, der für den Fett-Protein-Anteil bei einigen Mahlzeiten verabreicht wurde, wird bei den meisten Systemen von der automatischen Korrektur oder der adaptierten Basalrate zeitgerecht ersetzt.
- Das temporäre Anheben des Blutzuckerziel-Bereiches kann sowohl für körperliche Aktivität, langanhaltend geistige Konzentration, z. B. bei Klausuren, Vorträgen oder auch bei Alkoholkonsum genutzt werden, um eine Hypoglykämie zu vermeiden.
- Manche Eltern und Patientinnen bzw. Patienten versuchen, die Korrektur der Insulinpumpe zu schärfen, indem sie eine Kohlenhydratmenge als Mahlzeit angeben, die aber nicht gegessen wird (sog. fake-carbs). Ein solches Vorgehen ist bei den o. g. AID ungünstig, und es sollte mit den Betreffenden andere Lösungen gefunden werden.
- Für die Behandlung einer Hypoglykämie wird bei AID-Systemen eine kleinere Menge schnell resorbierbare Kohlenhydrate eingesetzt. Dies soll verhindern, dass ein überschießender Wiederanstieg des Blutzuckers automatisch korrigiert wird und es damit zu unnötigen Blutzucker-Schwankungen kommt. In einigen Systemen kann die Hypoglykämiebehandlung dokumentiert werden, damit diese nicht als fehlender Mahlzeiten-Bolus bewertet wird.
- Um die technischen Möglichkeiten umfassend nutzen zu können, sollten die Bedienung des Menüs von Pumpe und App eingehend geübt werden.
- Die Familien sollten – ausgerichtet an ihren Kenntnissen und Fähigkeiten – darin unterstützt werden, ihre generierten Daten zu teilen (Abb. 4). So kann einerseits das Diabetesteam die Insulinabgabe und den CGM-Verlauf auch aus der Ferne beurteilen und die Therapie bei Bedarf anpassen. Andererseits profitieren auch die Patientinnen und Patienten von ihrer Selbstbeurteilung, um etwa Behandlungsfehler oder verbesserungswürdige -muster zu erkennen.
Mit Hilfe der verbesserten Diabetestechnologie, Digitalisierung und innovativen Schulungskonzepten interdisziplinärer Teams können Kinder und Jugendliche mit Diabetes mellitus Typ 1 zunehmend besser behandelt werden.
Als Therapieziele gelten neben der normnahen Stoffwechsellage mit HbA1c < 7 % und einer Zeit im Zielbereich (TiR) > 70 % seltene Phasen von Hypoglykämie (< 4 %) und eine möglichst geringe Verweildauer (< 25 %) in der Hyperglykämie. Daneben soll die Therapie dazu verhelfen, akute Stoffwechselentgleisungen zu vermeiden und diabetesbedingten mikro- und makrovaskulären Folgeerkrankungen vorzubeugen. Insgesamt soll eine normale körperliche Entwicklung mit Längenwachstum, physiologischer Gewichtszunahme und Pubertät gesichert werden. Dies könnte zu einer weitgehend altersgerechten psychosozialen Entwicklung der jungen Patientinnen und Patienten und somit einem guten Leben mit ihrer Diabeteserkrankung beitragen.
- Der Diabetes mellitus Typ 1 ist in der Kinder- und Jugendmedizin mittlerweile die vorherrschende Stoffwechsel- und Autoimmunerkrankung.
- Die diabetische Ketoazidose bei Manifestation wäre vielfach vermeidbar, wenn über die charakteristischen Symptome umfassend aufgeklärt würde.
- Mit Hilfe der verbesserten Diabetestechnologie, Digitalisierung und innovativen Schulungskonzepten interdisziplinärer Teams können Kinder und Jugendliche mit Diabetes mellitus Typ 1 zunehmend besser behandelt werden.
Dr. Nicola Matejek
Erschienen in: Kinderärztliche Praxis, 2022; 93 (4) Seite 305-314