In einer Phase-3- Studie wurde ein RSV-Prefusions-F-Protein-Impfstoff zur maternalen Immunisierung bei 18 – 49 Jahre alten schwangeren Frauen mit Blick auf Sicherheit und Wirksamkeit geprüft. Die Studie wurde vorzeitig abgebrochen.
Neben monoklonalen Antikörpern zur Prophylaxe von schweren Infektionen durch das respiratorische Synzytialvirus (RSV) bei Säuglingen sind darüber hinaus Aktivimpfstoffe in der klinischen Erprobung. Im Fokus steht die Immunisierung von Kleinkindern sowie Senioren, aber auch die maternale Immunisierung mit dem Ziel, durch den diaplazentalen Antikörperübertritt Neugeborene bereits gegen schwere RSV-Infektionen zu schützen. Hierzu sind zuletzt 2 Impfstoffkonzeptionen geprüft worden.
Ein RSV-Prefusions-F-Protein-Impfstoff (RSVPreF3-Mat) zur maternalen Immunisierung wurde in einer Phase-3-Studie bei 18 – 49 Jahre alten, schwangeren Frauen mit Blick auf Wirksamkeit und Sicherheit geprüft. Es wurden insgesamt 5.328 Schwangere in die Studie eingeschlossen. Es fand eine 2:1-Randomisierung (RSVPreF3-Mat oder Placebo) zwischen der 24.+0 und 34.+0 Schwangerschaftswoche statt. Primäres „Outcome“ waren medizinisch zu versorgende tiefe Atemwegsinfektionen durch RSV bei jungen Säuglingen 6 Monate nach der Geburt sowie die Sicherheit bei den Säuglingen innerhalb der ersten 12 Lebensmonate.
Insgesamt sollten 10.000 Schwangere in die Studie eingeschlossen werden. Nachdem 3.426 Säuglinge der Verum-Gruppe und 1.711 Säuglinge der Placebo-Gruppe in die Studie eingeschlossen wurden, entschied der Sponsor sich, die Studie abzubrechen, da zunächst in der Verum-Gruppe und später auch in der Placebo-Gruppe ein erhöhter Anteil an Frühgeburtlichkeit auftrat. Im Februar 2022 berichtete das unabhängige Data-Monitoring-Komitee (DMC) eine höhere Inzidenz von Frühgeborenen in der Vakzine-Gruppe (7,6 %; 183 von 2.419 Frühgeborenen) als in der Placebo-Gruppe (5 %; 60 von 1.199 Frühgeborenen). Hieraus ließ sich ein relatives Risiko von 1,51 (95 %-KI 1,14 – 2,01, p = 0,04) ableiten.
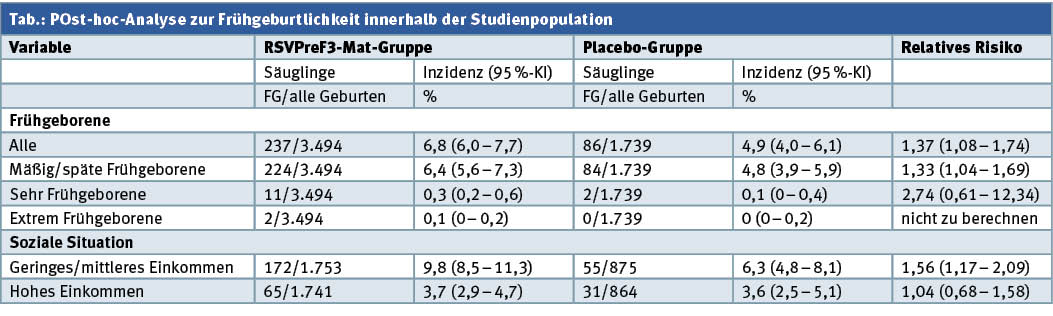 Die Tabelle gibt Daten zur Post-hoc-Analyse zum Frühgeburtlichkeitsrisiko innerhalb der Studienpopulation wieder.
Die Tabelle gibt Daten zur Post-hoc-Analyse zum Frühgeburtlichkeitsrisiko innerhalb der Studienpopulation wieder.
Das Sicherheitssignal „Frühgeburtlichkeit“ trat mit einem relativen Risiko von 1,56 in den Ländern mit niedrigen oder mittleren Einkommen auf. In wohlhabenderen Ländern trat im Vergleich zu Placebo keine erhöhte Frühgeburtlichkeit auf. Es kann daher nicht ausgeschlossen werden, dass nicht die Prüfvakzine, sondern soziale Umstände das Sicherheitssignal befeuert haben. Bis zum Studienabbruch lag die Wirksamkeit gegen jede Form von medizinisch zu versorgenden RSV-Infektionen bei Neugeborenen maternal immunisierter Mütter bei 65,5 % (37,5 – 82,0) und bei 69 % (33 – 87,6) mit Bezug auf schwere, tiefe Atemwegsinfektionen durch RSV.
Insgesamt kann festgehalten werden, dass neben den Sicherheitsbedenken auch eine vergleichsweise niedrige, eingeschränkte Wirksamkeit (69 %) gegen schwere Atemwegsinfektionen bei neugeborenen Kindern nach maternaler Immunisierung vorgelegen hat.
Erschienen in: Kinderärztliche Praxis, 2024; 95 (4) Seite 252