Bei chronischen Schmerzen am Bewegungsapparat ist in nicht seltenen Fällen auch an chronische Autoinflammationserkrankungen zu denken, z. B. an die nichtbakterielle Osteomyelitis. Ein Fallbeispiel und aktuelle Entwicklungen beschreibt der folgende Beitrag.
In der Differenzialdiagnose des chronischen Schmerzes am Bewegungsapparat steht zum einen die bakterielle Infektion, wie in dem Artikel von Tobias Tenenbaum aufgeführt, im Vordergrund. In durchaus nicht seltenen Fällen ist aber auch an chronische Autoinflammationserkrankungen, wie z. B. die chronische nichtbakterielle Osteomyelitis (CNO), zu denken. Flankiert wird die Differenzialdiagnose durch Knochen- oder Bindegewebsanlagestörungen, durch Traumata, durch knöcherne Stoffwechselerkrankungen durch einen Vitamin-D-Mangel oder auch durch onkologische Grunderkrankungen mit zum einen gutartiger, aber auch maligner Genese.
In dieses Spannungsfeld der komplexen Differenzialdiagnose hinein wollen wir die Krankheitsbilder der Osteomyelitis im Kindes- und Jugendalter darstellen.
Fallbeispiel: CNO mit erschwertem Verlauf
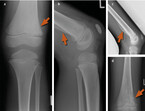
Beispielhaft für die chronisch nichtbakterielle Osteomyelitis ist die Anamnese eines damals 7 Jahre alten Jungen. Er klagte über nächtliche Schmerzen im linken Bein, nahe des Kniegelenkes. Dies wurde initial als Wachstumsschmerz interpretiert, von orthopädischer Seite wurde eine Schleimbeutelentzündung diagnostiziert und Paracetamol verordnet. Bei fehlender Besserung erfolgte eine Labordiagnostik (CRP 9 mg/l, BSG 50 mm/h, Blutbild unauffällig) und eine Röntgen-Diagnostik ohne "wegweisenden" Befund (Abb. 1 a, b).
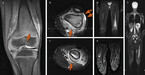
Eine Kernspintomographie ergab den Verdacht auf einen "Tumor" im Bereich des linken distalen Femurs mit Beteiligung der lateralen Compacta und des Periosts (Abb. 2 a, b). Es erfolgte die Biopsie des linken distalen Femurs. Sie ergab eine entzündliche Aktivität der Läsion (reichlich Granulozyten, Lymphozyten, Makrophagen, fibrotische Areale, CD1a negativ, S100 vereinzelt positiv) mit osteolytischer und fibrotischer Komponente. Eine eitrig granulierende bakterielle Osteomyelitis erschien wahrscheinlich, ein kultureller Keimnachweis gelang nicht. Eine antibiotische Therapie wurde durchgeführt (Cefuroxim, Clindamycin 3 Wochen i. v., gefolgt von 3-wöchiger oraler Clindamycin-Therapie).
Innerhalb von etwa 4 Wochen kam es zu einer deutlichen Besserung, die allerdings nur für die Dauer von 4 Monaten anhielt. Das Kind wirkte müde, es kam lokal erneut zu Schwellung und Schmerzhaftigkeit des linken Knies. Die Eltern berichten von subfebriler Temperatur. Die Labordiagnostik (Blutbild, BSG und CRP) war unauffällig, man vermutete ein Rezidiv der bakteriellen Osteomyelitis und strengte erneut Bildgebung (Abb. 1 c, d) und eine nochmalige Biopsie an. Diese hatte erneut keinen Tumor bestätigen lassen, vielmehr lag wiederum ein entzündlicher Prozess vor. Ein Erregernachweis gelang konventionell durch Anzucht und nun auch mittels molekularbiologischen Techniken (eubakterielle rRNA-Amplifikation) nicht. Aufgrund der Ausprägung des Befundes hatte man jedoch weiterhin eine Infektion favorisiert. Eine Bartonellen-Serologie ergab einen früheren Kontakt mit dem Erreger. Ein IgM-Nachweis bestand nicht. Es erfolgte erneut eine antibiotische Therapie mit je Clindamycin und Rifampicin für die Dauer von 3 Wochen i. v., Clindamycin wurde dann noch 6 Wochen oral weitergeführt. Eine zusätzliche bedarfsbezogene entzündungshemmende Therapie mit Ibuprofen führte in Kombination zu einer Besserung. Zu diesem Zeitpunkt wurde die Betreuung in unsere Hände gegeben. Der muskuloskelettale und Gelenkstatus zeigte eine mittelgradige knöcherne und auch Weichgewebsverdickung des distalen linken Oberschenkels, nahe des Kniegelenks. Lokal bestand kein Druckschmerz, keine Rötung oder Überwärmung. Das Kniegelenk war unauffällig. Keine Rachitiszeichen. Die Inspektion der Haut zeigte 2 reizlose OP-Narben im Bereich des linken Oberschenkels und keinen Hinweis auf Schuppenflechte.
Differenzialdiagnostisch war zu diesem Zeitpunkt auch an das Vorliegen einer chronisch nichtbakteriellen Osteomyelitis (CNO) zu denken, u. a. da ein Keimnachweis nicht gelungen war und die hyperostotische Komponente als Folge der Inflammation bereits bei Erstvorstellung bestand. Eine Kernspintomographie mit Ganzkörpertechnik sollte daher eine mögliche Multifokalität der Läsion einschätzen lassen: 4 Monate nach der zweiten Biopsie waren weiterhin inflammatorische Veränderungen sowohl im Knochenmark als auch der Compacta und des Periostes im linken Femur nachweisbar (Abb. 2 d). Eine weitere klinisch silente Läsion zeigt sich am 4. Mittelfußstrahl der rechten Seite (Abb. 2 e). Eine dauerhafte antiphlogistische Therapie mit Naproxen (13 mg/kgKG) wurde nach dem GK-MRT-Befund begonnen und gut toleriert. Im weiteren Verlauf traten regionale Oberschenkelschmerzen schubartig jeweils nach mehreren Monaten auf, dabei bestand manchmal Temperaturerhöhung und Gewichtsverlust in den Akutphasen. Diese Schübe hielten für etwa 1 Woche an. In 9 Jahren waren 18 Schübe zu verzeichnen, etwa alle 6 Monate. Dazwischen war der Junge beschwerdefrei und leistungsfähig. Nach einem Jahr hatten wir Sulfasalazin (45 mg/kg KG) in die Betreuung hineingenommen, ohne dass ein Effekt auf die Schubhäufigkeit entstand, aber etwas die Länge und Intensität verkürzte. Nach 5 Jahren wurde diese Medikation beendet, die Naproxen-Therapie auf eine sehr niedrige "Erhaltungsdosis" von 5 mg/kg KG reduziert, ein positiver Effekt auf die Beschwerden wurde weiter berichtet. Gelegentlich wies der Junge Bauchschmerzen auf; Blut im Stuhl oder Durchfall wurde nie beobachtet.
Pathophysiologische Betrachtung und aktuelle Entwicklungen zu Klassifikation und Therapie der CNO
Da an einer zweiten Stelle, dem 4. Zehenstrahl rechts, ebenso eine Signalintensitätsstörung bestand, konnte nun von einem multifokal entzündlichen Prozess bei dem Jungen ausgegangen werden. Die CNO/CRMO (chronisch rezidivierende multifokale Osteomyelitis) wird heute in autoinflammatorische Erkrankungen eingeordnet [1]. Es liegen grundlagenwissenschaftliche Untersuchungen vor, welche eine profunde Dysregulation der Zytokinexpression in Monozyten von CNO-Patienten dokumentierten. Konkret besteht eine eingeschränkte Produktion der immunregulatorischen Zytokine Interleukin 10 und 19, zum anderen zeigen diese Zellen eine Überexpression von NLRP3-Inflammasom abhängigen proinflammatorischen Zytokinen, z. B. Interleukin 1 beta und TNF alpha. Letzteres Zytokinmuster findet sich auch in CNO-Gewebeproben. Eine genetische Prädisposition konnte für die "sporadisch" auftretende CNO bisher nicht identifiziert werden [2].
In wenigen Einzelberichten war allerdings eine Zuordnung zu monogenetischen Erkrankungen möglich. In der Regel würde aber die Suche nach genetischen Ursachen auch mit autoinflammatorischen Panel-Untersuchungen auf der Basis von "Next generation sequencing (NGS)"-Technik zum jetzigen Stand des Wissens ins Leere laufen. Sollten allerdings hämatologische Auffälligkeiten wie Anämie, besonders ausgeprägt pustulös entzündliche Hautläsionen (Sweet-Syndrom) oder auch ein besonders auffälliger Mandibulabefall mit entzündlich destruktiven Veränderungen (Cherubismus) bestehen, oder auch eine erniedrigte alkalische Phosphatase im Blut messbar sein, dann ist sicherlich eine genetische Diagnostik zielführend [2].
Die häufig betroffenen Knochen-Lokalisationen sind Epiphysen und vor allem Metaphysen der langen Röhrenknochen, die Beckenknochen in der Nähe der Iliosakralfuge und der Y-Fuge, des Weiteren der Schultergürtel vor allem von Clavicula und Sternum. Die Wirbelsäule ist ebenso häufig betroffen. Selten ist eine "monofokale Sonderform" der Mandibula-Hyperostose. Das Neurokranium ist in der Literatur als Manifestationsort praktisch nicht beschrieben. Die Erkrankung bleibt auch heute, trotz laufender Anstrengungen Klassifikationskriterien zu entwickeln, eine Ausschlussdiagnose.
Allen voran und insbesondere bei unifokaler Läsion ist eine infektiöse Osteomyelitis zu bedenken (siehe Beitrag von Tobias Tenenbaum in diesem Heft). Ein multifokaler Befund ist selten durch eine Staphylococcus-aureus-Infektion verursacht, zu denken ist an Erreger wie Kingella kingae, Bartonella henselae, typische und atypische Mykobakterien [3]. Besonders diskutiert wurde vor allem Propionibacterium/Cutibacterium acnes. Dieser Erreger wurde vor allem in den 90er-Jahren mit der CNO und insbesondere dem im Erwachsenenalter dazu verwandten SAPHO-Symptomenkomplex (Synovitis, Akne, Pustulosis, Hyperostosis) assoziiert. Kalkulierte antibiotische Therapie, z. B. mit Azithromycin, oder generell nach Leitlinie für eine bakterielle Osteomyelitis sind bei der CNO allerdings in der Regel nicht dauerhaft wirksam [4]. Nicht selten wird zwar im Alltag zu Beginn eine antibiotische Therapie aus konzeptionellen Gründen begonnen, meist kann sie dann zügig im Verlauf nach Sichtung aller Befunde und ggf Erhalt der mikrobiellen Ergebnisse beendet werden [5]. Auch wenn zum jetzigen Zeitpunkt 3 Klassifikationvorschläge zur Einordnung als CNO publiziert/diskutiert sind, bleibt im klinischen Alltag der CNO-Symptomenkomplex (Chronizität, Prädilektionsstellen, Betonung des jugendlichen Alters mit moderater Weiblichkeitswendung, das Fehlen eines Erregernachweises im Biopsat, entzündliche und fibrosierende histologische Veränderungen, nicht konklusive Laborparameter) manchmal schwer fassbar [6 – 8]. Auch wenn das Gewebsmerkmal HLA-B27 als möglicher immunologischer Marker für einen schwereren Verlauf der CNO publiziert wurde, besteht sicherlich keine direkte Relevanz für die Diagnosestellung einer CNO [2]. Die Gesamtprävalenz von HLA-B27 ist bei Betroffenen mit CNO nicht erhöht [9, 10]. In der Abgrenzung zur Spondylarthropathie SPA/Enthesitis-assoziierten Arthritis mag HLA-B27 dennoch relevant sein.
Bei unserem Fallbeispiel scheinen die Diagnosekriterien für CNO mit multifokalem Muster (chronisch rezidivierende multifokale Osteomyelitis, CRMO) und einer im Vordergrund stehenden Hauptmanifestation am Femur erfüllt: Es handelt sich um einen chronisch-inflammatorischen Prozess (Dauer länger als 6 Wochen), der alle Knochenschichten und auch das Periost miterfasst, eine Malignität (auch Langerhans-Zell-Histiozytose) und Knochenstoffwechselstörung wurden ausgeschlossen und ein Erregernachweis gelang nicht, ein rezidivierender Verlauf lag vor [11]. Die Verdachtsdiagnose einer CNO wurde durch repetitive MRTs über 10 Jahre kontrolliert und damit ebenso erhärtet.
- CNO: chronisch nichtbakterielle Osteomyelitis
- CRMO: chronisch rezidivierende multifokale Osteomyelitis
- GK-MRT: Ganzkörper-Magnetresonanztomographie
- NGS: Next generation sequencing
- NSAID: Nicht Glukokortikoid-haltige entzündungshemmende Medikamente
- PD: Protonendichte-gewichtete Sequen
- SAPHO: Synovitis acne pustulosis hyperostosis osteitis syndromez
- TIRM: Turbo inversion recovery measurement
- TSE: Turbospinecho-Sequenz
- SPA: Spondyloarthropathie
Aktuelle Entwicklungen zur Therapie der CNO
Da zum jetzigen Zeitpunkt keine vergleichende randomisierten Studien zur Therapie der CNO vorliegen, gründen sich die Therapieempfehlungen auf historischen Erfahrungen innerhalb unterschiedlich großer Patientenkohorten, teilweise einzelnen Kasuistiken. Nationale und internationale Register-Analysen dokumentieren eine passabel gute bis sehr gute Wirksamkeit von nichtsteroidalen Antirheumatika. Expertenbasierte Empfehlungen zu immunologisch/rheumatologischen Basistherapeutika einschließlich Methotrexat, Sulfasalazin und auch Biologika (TNF-alpha-Inhibitoren) liegen vor. Auch der Glukokortikoideinsatz über kurze Zeit in mittelhoher Dosierung wurde zur Kupierung von entzündlichen Schüben dokumentiert. Insbesondere bei besonders schmerzhaften Episoden, bei Wirbelkörper- oder Mandibulabeteiligung gibt es gute therapeutische Berichte zum Bisphosphonat-Einsatz. Vor allem das Medikament Pamidronat in der intravenösen Anwendung hat hier großen Stellenwert erlangt. Andere Bisphosphonate, z. B. Zoledronat oder Neridronat sind in ihrer Wirksamkeit noch weitgehend nicht erforscht.
Aufgrund dieser fehlenden Studienlage hat man international Therapieoptionen im Rahmen sogenannter zielgerichteter Therapieprotokolle konsentiert. Im Wesentlichen werden darin konventionelle rheumatologische Basistherapeutika (Methotrexat, Sulfasalazin) mit TNF-blockierenden Biologika verglichen. Eine 3. Option, der Einsatz von Bisphosphonaten wird einerseits besonders bei Wirbelkörperbeteiligung favorisiert, zum anderen auch als 3. Therapieschiene überlegt [11]. Da es sich allerdings nicht um streng kontrollierte Therapiestudien handelt, bleibt aktuell die Schwierigkeit, aus dem klinisch variablen Krankheitsbild enger gefasste, möglicherweise therapeutisch besser abgestimmte CNO-Subentitäten für die genannten Therapiestrategien auszuwählen. Grundsätzlich besteht auch die Schwierigkeit, dass Therapieziele bei der CNO streng genommen noch nicht ausreichend definiert sind: Ist es vom Patienten als ausreichend angesehen, eine klinische Beschwerdefreiheit zu erreichen, dann wird in der Regel der Einsatz von NSAID durchaus hilfreich sein? Besteht aber das Therapieziel darin, eine radiologische Komplettremission zu erreichen, dann werden eine deutlich intensivere Therapie und durchaus auch der Einsatz von rheumatologischen Basistherapeutika erforderlich sein [11]. Es fehlen Daten und Kriterien, um den optimalen Wechselzeitpunkt hin zu dem nächsten Therapiealgorithmus festzulegen.
Nach unserer Ansicht/Erfahrung ist es von großer Wichtigkeit, möglichst früh in der Manifestation der Erkrankung eine konsequente entzündungshemmende Therapie mit NSAID durchzuführen. Darin besteht die Chance, sowohl eine solide Besserung des Beschwerdebildes als auch der Bildgebung bei bis zu 2/3 der Patienten allein mit NSAID zu erreichen [9]. Auch das Ziel einer Komplettremission ist für den einzelnen Patienten möglich, sogar wenn man das am strengstens gefasste Therapieziel der radiologischen Befundnormalisierung anlegt.
Bei unserem Patienten wurde die gezielte CNO-Therapie nach etwa einem Jahr Manifestation begonnen. Eine im Alltag gute Lebensqualität wurde in Abstimmung mit der Familie erreicht, allerdings keine radiologische Remission (Abb. 2 f). Die Manifestation im Schaft von langen Röhrenknochen erscheint auch in großen Kohorten mit einem schwierigeren Verlauf dokumentiert. Aktuell zu befürchten ist, dass allgemein verbindliche Therapieempfehlungen auch aus den aktuellen Register-Sammlungen mit abgestimmten Therapiewegen, z. B. für unseren Patienten und seine durchaus besondere Manifestation, nur begrenzt entstehen werden und dass weiterhin die CNO-Therapie einer fundierten Fachexpertise bedarf.
- Bei der CNO ist eine monogenetische Ursache bisher noch nicht definiert.
- Zytokinimbalanzen in Gewebe und Blut scheinen die Entzündung zu unterhalten.
- Das Ganzkörper-MRT ist der diagnostische Standard.
- Eine Biopsie ist bei monofokalen Befunden zu bedenken.
- NSAID sind meist therapeutisch hilfreich.
- Basistherapeutika (Bisphosphonate, Sulfasalzine, Mtx, Biologika)
- Klassifikation und diagnostische Verlaufskriterien sind noch nicht international konsentiert, werden aber aktuell international abgestimmt.
Erschienen in: Kinderärztliche Praxis, 2022; 93 (4) Seite 265-270